Hola:
Vamos a aprovechar esta entrada para crear una unidad didáctica sobre Estructura del átomo, contenido correspondiente a 3º de ESO.
En ella recorreremos la historia de la Química desde los años 1805 a 1926, entre los cuales se evolucionó desde el primer modelo, el de Dalton, hasta que se planteó la base de lo que constituye el modelo actual, el mecanocuántico.
 |
| John Dalton |
Para ello, planteó las siguientes suposiciones:
- Los elementos químicos están formados por partículas muy pequeñas e indivisibles llamadas átomos.
- Todos los átomos de un elemento químico son idénticos en masa y propiedades.
- Los átomos de diferentes elementos químicos son distintos; en particular, sus masas son diferentes.
- Los átomos son indestructibles y retienen su identidad en los cambios químicos.
- Los compuestos se forman cuando átomos de diferentes elementos se combinan entre sí, en una relación de números enteros sencilla, fomando entidades definidas.
Con esta teoría, Dalton reconoció la posibilidad que tienen los átomos de distintos elementos de combinarse entre sí y formar "átomos compuestos". El término "átomo compuesto" se sustituyó posteriormente por molécula (término debido a Amedeo Avogadro. Así, por ejemplo, según la teoría de Dalton, la formación de agua a partir de oxígeno e hidrógeno supone la combinación íntima de átomos de estos elementos para formar la molécula de agua.
Aunque la explicación de la formación del agua y otros compuestos que proporciona la teoría atómica es básicamente correcta, Dalton cometió algunos errores, como el de suponer que la molécula de agua contenía un átomo de oxígeno y otro de hidrógeno. Sin embargo, su teoría interpreta las leyes ponderales conocidas hasta el momento:
- La ley de conservación de la masa se explica porque un cambio químico es sólo una reordenación de átomos, sin que desaparezca ninguno.
- La ley de las proporciones constantes se explica porque, según los postulados de Dalton, una muestra de un compuesto es, sencillamente, una colección de muchas moléculas iguales, y la proporción en masa de sus elementos en la muestra es la misma que una molécula individual cualquiera del compuesto, es decir, fija.
En este video puedes ver, de forma resumida, los puntos principales de esta teoría:
El principal escollo se debió a que esta teoría no era capaz de interpretar los resultados obtenidos por J. L. Gay-Lussac, que en 1805 observó que la relación en la que se combinan en volumen los gases que intervienen en un cambio químico corresponden a números enteros sencillos (Ley de Gay-Lussac).
Para interpretarlo, el químico italiano Amedeo Avogadro consideró que las partículas de algunos elementos gaseosos estaban formados por dos átomos. A estas agrupaciones de átomos las llamó moléculas. Además, propuso la denominada Hipótesis de Avogadro.
"Volúmenes iguales de gases diferentes, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas".
Modelo atómico de Thomson
El descubrimiento del electrón por Joseph John Thomson como la partícula responsable de la electricidad y de los fenómenos eléctricos, unido a la constatación de que estos electrones se encuentran en cualquier sustancia, llevó a los científicos a sospechar que los átomos debían ser partículas complejas formadas por otras más simples.
 |
| Joseph John Thomson |
El átomo es una esfera maciza de carga eléctrica positiva.
Los electrones están incrustados en esta esfera maciza en un número suficiente como para neutralizar la carga eléctrica positiva de la esfera.
El modelo atómico de Thomson tuvo una gran aceptación durante cierto tiempo, pero una serie de experimentos pusieron pronto en entredicho su validez.
 |
| Ernest Rutherford |
En 1911, Ernest Rutherford (físico y químico inglés y discípulo de Thomson) y sus colaboradores, analizaron con detalle el experimento del bombardeo de la lámina de oro que ya realizó Thomson, llegando a las siguientes conclusiones:
- La mayor parte de las partículas a atravesaron la lámina sin cambiar de dirección, como era de esperar según el modelo de Thomson.
- Algunas se desviaron considerablemente.
- Unas pocas partículas rebotaron hacia la fuente de emisión.
Modelo atómico de Rutherford
El comportamiento de las partículas no podía ser explicado con el modelo de Thomson, así que Rutherford lo abandonó y sugirió otro basado en un átomo nuclear. Según este modelo, el átomo constituye un espacio fundamentalmente vacío, ocupado por electrones que giran alrededor de un núcleo central muy denso y pequeño.
Los neutrones
La masa de protones y electrones por sí sola no coincidía con la masa total del átomo, y Rutherford supuso que en el núcleo tenía que existir otro tipo de partículas subatómicas y que bautizó como neutrón.
Posteriormente, el físico inglés J. Chadwick, descubrió estas partículas, que, al no tener carga eléctrica, se llaman neutrones. Los neutrones son, pues, partículas eléctricamente neutras que tienen una masa ligeramente mayor que la de los protones y que se encuentran, junto a estos, en el núcleo.
El átomo nuclear
Todo esto nos permite describir el átomo del siguiente modo:
- El átomo tiene un núcleo central en el que está concentrada prácticamente toda su masa, aportada por los protones y los neutrones.
- La carga positiva de los protones se compensa con la carga negativa de los electrones, que se hallan fuera del núcleo. Así, el átomo es eléctricamente neutro.
- El núcleo contiene, por tanto, protones en un número igual al de electrones del átomo.
- Los electrones giran a mucha velocidad en torno al núcleo y están separados de este por una gran distancia.
Aciertos y objeciones al modelo de Rutherford
El hecho de que cada átomo tenga un espectro de rayas distinto y discontinuo debe estar relacionado con su estructura. El modelo atómico de Rutherford no era capaz de explicar la emisión de radiación.
Modelo atómico de Bohr
A fin de solucionar el problema planteado por los espectros atómicos y de explicar la no emisión de energía por los electrones en órbita, el danés Niels Bohr formuló, en 1913, una hipótesis sobre la estructura atómica. Para ello estableció unos postulados que se pueden resumir así:
- El electrón sólo se mueve en unas órbitas circulares "permitidas" (estables) en las que no emite energía. El electrón tiene en cada órbita una determinada energía, que es tanto mayor cuanto más alejada esté la órbita del núcleo.
- La emisión de energía se produce cuando un electrón salta desde un estado inicial de mayor energía hasta otro de menor energía.
El átomo de hidrógeno según el modelo atómico de Bohr
Las hipótesis de Bohr permiten explicar la estructura del átomo de hidrógeno y sus espectros atómicos. De ellas se deduce que:
- El átomo de hidrógeno tiene un núcleo con un protón.
- Posee un electrón que gira en la órbita alrededor del núcleo, en la que posee menor energía.
- Si se comunica energía al electrón, este salta desde esta órbita hasta otra en la que tendrá mayor energía. Cuando el electrón salta a la órbita inicial, emite esta energía de más en forma de radiación luminosa.
Distribución de electrones
Con el modelo atómico de Bohr sólo se podía explicar el espectro del átomo de hidrógeno. Hacia 1920 se introdujeron nuevas modificaciones y se desarrollaron nuevos modelos atómicos para explicar, al menos cualitativamente, las propiedades químicas de los distintos elementos.
De acuerdo con este nuevo modelo, alrededor del núcleo hay capas o niveles de energía, que tradicionalmente se representan mediante las letras K, L, M y N, respectivamente.
En cada capa se sitúa un número máximo de electrones: - La más interna o cercana al núcleo (nivel 1): 2 electrones.
- La segunda (nivel 2): 8 electrones.
- La tercera (nivel 3): 18 electrones.
- La cuarta (nivel 4): 32 electrones.
El modelo atómico actual
- Los átomos son eléctricamente neutros. Están formados por igual número de protones y electrones, y por un cierto número de neutrones.
- Los protones y neutrones se sitúan en el núcleo, que posee carga positiva.
- Los electrones forman la corteza. Se disponen en niveles de energía y, dentro de estos, en diferentes orbitales. Pueden pasar de unos niveles a otros absorbiendo o emitiendo energía.
El modelo atómico actual es muy complejo. Se basa en complicados cálculos matemáticos y considera que los electrones no pueden localizarse con exactitud en órbitas elípticas, sino en regiones del espacio determinadas, a las que se denomina orbitales atómicos . Los orbitales atómicos tienen distintas formas y se nombran con las letras s, p, d y f. Sus formas varían dependiendo de qué orbital se trate:
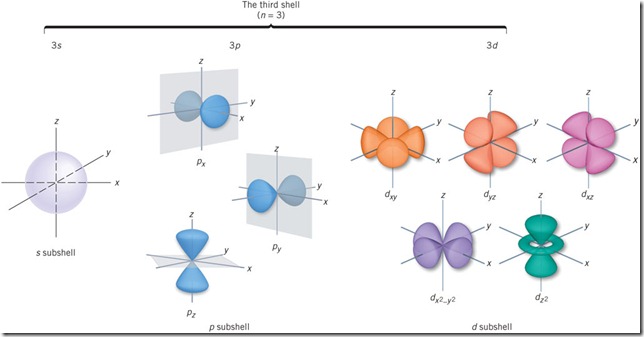 No obstante, podemos describir la estructura interna del átomo de una forma sencilla, suficiente para explicar las propiedades físicas y químicas más importantes de la materia.
No obstante, podemos describir la estructura interna del átomo de una forma sencilla, suficiente para explicar las propiedades físicas y químicas más importantes de la materia.El modelo de Rutherford se basa en leyes y principios de la Mecánica clásica. Es de poca dificultad matemática, sencillo y permite una buena representación gráfica. Rutherford supuso que, al igual que los planetas giran alrededor del Sol, los electrones tenían que hacerlo alrededor del núcleo. En caso contrario, es decir, si el electrón permaneciera en reposo, la atracción entre cargas de diferente signo haría que aquel se aproximara al núcleo de forma inevitable y el átomo sería, pues, inestable. La hipótesis de un electrón que gira continuamente alrededor del núcleo creaba un nuevo problema, aparentemente insuperable: era un hecho conocido en física que cualquier carga que girase alrededor del núcleo debería emitir energía en forma de radiación. Según esto, el electrón iría perdiendo energía continuamente y se acercaría cada vez más al núcleo, es decir, se movería en espiral, hasta caer sobre él. Pero esto no es lo que ocurre.
Si un haz de luz blanca atraviesa un prisma de vidrio, observarás que este se descompone en los colores del arco iris. El prisma dispersa o separa los colores (radiaciones) que componen la luz blanca.
Si recoges en una pantalla estas radiaciones, se obtienen unas zonas coloreadas. Esto es lo que se conoce como espectro continuo de la luz visible.









No hay comentarios:
Publicar un comentario